La ŝlosila diferenco inter nitrato kaj nitrito estas, ke nitrato enhavas tri oksigenajn atomojn ligitajn al nitrogena atomo dum nitrito enhavas du oksigenajn atomojn ligitajn al nitrogena atomo.
Ambaŭ nitrato kaj nitrito estas neorganikaj anioj konsistantaj el nitrogeno kaj oksigenaj atomoj. Ambaŭ ĉi tiuj anioj havas -1 elektran ŝarĝon. Ili ĉefe okazas kiel la aniono de salaj komponaĵoj. Estas iuj diferencoj inter nitrato kaj nitrito; Ni diskutos tiujn diferencojn en ĉi tiu artikolo.
Kio estas nitrato?
Nitrato estas neorganika aniono havanta la kemian formulon NO3–. Ĝi estas poliatomia aniono, kiu havas 4 atomojn; Unu atomo de nitrogeno kaj tri oksigenaj atomoj. La aniono havas -1 totalan ŝarĝon. La molara maso de ĉi tiu aniono estas 62 g/mol. Ankaŭ ĉi tiu aniono devenas de sia konjuga acido; acida acido aŭ HNO3. Alivorte, nitrato estas la konjuga bazo de la nitra acido.
Mallonge, nitrata jono havas unu nitrogenan atomon en la centro, kiu ligas kun tri oksigenaj atomoj per kovalenta kemia ligado. Kiam oni pripensas la kemian strukturon de ĉi tiu aniono, ĝi havas tri identajn neniujn ligojn (laŭ la resonaj strukturoj de la aniono). Tial la geometrio de la molekulo estas trigona ebenaĵo. Ĉiu oksigena atomo portas -2⁄3 ŝarĝon, kio donas la ĝeneralan ŝarĝon de la aniono kiel -1.
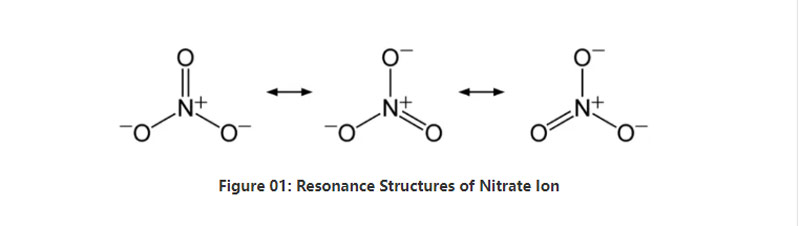
Ĉe norma premo kaj temperaturo, preskaŭ ĉiuj salaj komponaĵoj enhavantaj ĉi tiun anion solvas en akvo. Ni povas trovi nature okazantajn nitratajn salojn sur la tero kiel tavoloj; nitratinaj tavoloj. Ĝi plejparte enhavas natrian nitraton. Plie, nitrifigi bakteriojn povas produkti nitratan jonon. Unu el la ĉefaj uzoj de la nitrataj saloj estas en la produktado de sterkoj. Plue, ĝi utilas kiel oksidiga agento en eksplodaĵoj.
Kio estas nitrito?
Nitrito estas neorganika salo havanta la kemian formulon NO2-. Ĉi tiu aniono estas simetria aniono, kaj ĝi havas unu nitrogenan atomon ligitan al du oksigenaj atomoj kun du identaj neniuj kovalentaj kemiaj ligoj. Tial la nitrogena atomo estas en la centro de la molekulo. La aniono havas -1 totalan ŝarĝon.
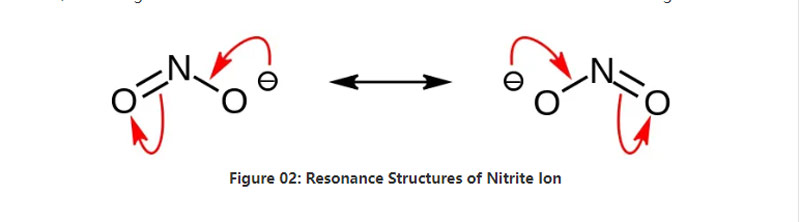
La molara maso de la aniono estas 46,01 g/mol. Ankaŭ ĉi tiu aniono devenas de la nitra acido aŭ HNO2. Tial ĝi estas la konjuga bazo de la nitra acido. Tial ni povas produkti nitritajn salojn industrie per pasantaj nitraj fumoj en akvecan natrian hidroksidan solvon. Plie, ĉi tio produktas natrian nitriton, kiun ni povas purigi per rekristaliĝo. Plue, nitritaj saloj kiel natria nitrito estas utilaj en konservado de manĝaĵoj ĉar ĝi povas malebligi manĝaĵojn de mikroba kresko.
Kio estas la diferenco inter nitrato kaj nitrito?
Nitrato estas neorganika aniono havanta la kemian formulon NO3 - dum nitrito estas neorganika salo havanta la kemian formulon NO2-. Tial la ĉefa diferenco inter nitrato kaj nitrito kuŝas sur la kemia konsisto de la du anioj. Tio estas; La ŝlosila diferenco inter nitrato kaj nitrito estas, ke nitrato enhavas tri oksigenajn atomojn ligitajn al nitrogena atomo dum nitrito enhavas du oksigenajn atomojn ligitajn al nitrogena atomo. Plie, nitrata jono devenas de ĝia konjuga acido; La acido nitria, dum la nitrita jono estas derivita de nitra acido. Kiel alia grava diferenco inter nitrataj kaj nitritaj jonoj, ni povas diri, ke nitrato estas oksidiga agento ĉar ĝi povas suferi la solan redukton, dum nitrito povas agi tiel oksidigante kaj reduktante agenton.
Afiŝotempo: Majo-16-2022





